|
|
EPO, CERA, POSITIVITA': DENTRO LA LA BATTAGLIA FRA LABORATORI E PERITI DI PARTE
|
Un dato emerge incontestabile nel panorama della lotta al doping: la evidente differenza tra gli ingenti sequestri di materiale dopante effettuati dalle forze dell’ordine e le relativamente esigue positività rilevate dai vari laboratori antidoping. Quella del laboratorio di Roma, uno dei più laboriosi e prestigiosi fra la trentina che compongono il panorama di quelli accreditati dalla Wada, l'agenzia antidoping mondiale è di circa il 2%. E per dare un'idea di quanto sia vasta la diffusione di certi prodotti come eritropoietina e hgh (ormone della crescita) basti pensare che per l'epo (la produzione censita nel 2008 assommava a 236 milioni di dosi, ma sfugge tutto il mercato nero su internet) per ogni malato ci sono dai 6 agli 8 "consumatori" sani. Per il gh (36 milioni di dosi) 1 malato e altri 4-6 altri "utilizzatori". I potenziali utilizzatori di prodotti dopanti erano stimati (indagine di "Libera") nel 2005 circa 450.000 con un incremento previsto all'epoca del 15%-20% l'anno e, ovviamente un giro di affari di decine di milioni di euro. Dunque: tanti dopati e pochi positivi. E in mezzo il laboratorio criticato per la sua efficienza anche e principalmente per le strategie difensive e utilitaristiche degli avvocati e dei periti difensori degli atleti “pizzicati” positivi. Non è peregrino, dunque, cercare di fare chiarezza, magari con un approccio “neutrale” e a base scientifica. Per questo ci siamo affidati ad uno dei tecnici più preparati ed esperti nel settore, il professor Dario D'Ottavio, già autorevole membro della CVD, la commissione per la vigilanza sulla legge antidoping (376/2000), nonché perito e consulente di molti pm nelle sempre più frequenti indagini doping nella penisola. Vi proponiamo questo accurato lavoro ben sapendo che la complessità dell'argomento impedisce una assolta banalizzazione dei temi e le necessità di esposizione richiedano comunque approfondimenti ulteriori che svilupperemo a mano a mano. |
CIO' CHE SI DEVE CONOSCERE SULLA DETERMINAZIONE DELL’EPO ESOGENA
di DARIO D'OTTAVIO
| STORIA DELL'EPO | TIPI DI EPO | FALSA POSITIVITA' | LE CUVE ROC | LE CRITICHE |
| I FALSI POSITIVI | L'IMMUNOBLOTTING | FALSI NEGATIVI | IL CASO BEKE' | IL RUOLO DEI PERITI |
Negli ultimi anni l’evoluzione del doping ha portato all’uso sconsiderato di nuove molecole, di rilevante interesse clinico, tra queste le più importanti sono “i fattori di crescita”.
Fattori di crescita emopoietici
nterleuchina-3 (IL-3 o multi-CSF)
Granulocyte-Macrophage-Colony-Stimulating Factor (GM-CSF)
Granulocyte -Colony-Stimulating Factor (G-CSF)
Colony-Stimulating Factor
Eritropietina (EPO)
Tromboopoietina
Sia per il notevole valore ergogenico che per la relativa facilità di reperimento sul mercato non tradizionale il fattore di crescita di elite è l’eritropoietina (o emopoetina). L’eritropoietina, prodotta per lo più dal rene (parzialmente dal fegato ed in quantità trascurabili da altri organi, è un potente stimolatore dell’attività del tessuto eritropoietico.
1905 Carnot e Deflandre ipotizzarono un fattore umorale regolasse
la produzione di globuli rossi, lo chiamarono eritropoietina
1936 Hjort dimostrò e confermò l'esistenza di questo fattore
1950 Reissmann dimostrò che l'espressione genica del fattore era
regolata dalla pressione
d'ossigeno
1953 Erslev dimostra inequivocabilmente
l’esistenza
dell’EPO
1957 Jacobson et all identificano il rene come principale organo
deputato alla produzione dell’EPO
1977 Miyake riuscì a purificare l'eritropoietina umana
successivamente utilizzata per la messa a punto di un metodo
radioimmunologico per la sua determinazione
plasmatica 1979 Sherwood e
Goldwasser definiscono i valori di EPO in soggetti normali e
morbosi 1981 Clonazione del gene dell’eritropoietina
umana
1985 Lin e Jacobs clonarono il gene dell'eritropoietina e
svilupparono una linea cellulare transfettata (cellule CHO) capace di
produrre eritropoietina ricombinante umana
1989 clonazione del recettore dell'EPO
2000 sintesi della darbepoetina
La sua produzione è regolata dalla quantità di ossigeno circolante che attiva o riduce lo stimolo dell’attività delle cellule preposte alla sua sintesi.
NOTA: L’unità Internazionale (UI) di eritropoietina endogena è definita come l’attività che induce lo stesso effetto eritropoietico di 5μmoli di Cobalto
L’ertitropoietina è una glicoproteina monometrica costituita da 165 amminoacidi , di peso molecolare 30.4 kDA ed altamente glicata ( i carboidrati rappresentano ca. il 30% della molecola). La frazione glicidica è costituita prevalentemente (40% ca) da acido sialico. L’acido sialico non influenza l’attività biologica della molecola ma costituisce un elemento indispensabile per impedirne il catabolismo consentendo, quindi, una sua permanenza in circolo più elevata.
L’attività “protettiva dell’acido sialico è evidenziata dal fatto che una sua rimozione, provocando l’esposizione dei residui galattosidici, favorisce il legame di questi ai recettori presenti sugli epatociti. Ciò induce la fagocitosi della molecola ed una sua rapida inattivazione da parte dei lisosomi.
MIDOLLO OSSEO
![]()
![]()
![]() Cellule
staminali BFU-E CFU-E Precursori della serie
eritroide
Cellule
staminali BFU-E CFU-E Precursori della serie
eritroide
![]()



 Eritropoietina
Eritrociti
Eritropoietina
Eritrociti
![]() Ossigeno atmosferico
Ossigeno atmosferico
![]()
![]() Ossigeno Funzione cardiopolmonare
Ossigeno Funzione cardiopolmonare
 ai tessuti
ai tessuti ![]() Volemia
Volemia
![]() Concentrazione di emoglobina
Concentrazione di emoglobina
![]() Affinità
per l’Ossigeno
Affinità
per l’Ossigeno
Produttori di eritropoietina
(Tubuli renali, cellule epatiche di Kupfer, macrofagi)
La glicazione della molecola, responsabile della sua stabilità “in vivo”, ha indotto le case produttrici a mettere in commercio prodotti modificati, che pur avendo la stessa struttura primaria della molecola endogena, fossero più “resistenti” al catabolismo cellulare. Tale caratteristica, aumentando la persistenza in circolo, permetterebbe quindi all’EPO di espletare un’azione persistente consentendo, a parità di effetto, di ridurne la quantità somministrata.
TIPI DI ERITROPOIETINA![]()
Epoetina α Epoetina β Epoetina ω Epoetina δ
Eprex Epoch Epomax Dynepo
Epoade Epogin Hemax
Epogen Eritrogen
Epopen Erantin
Epoxitin Marogen
Erypo Neorecormon
Espo Recormon
Globuren
Procrit
L’ultima generazione di EPO commerciali coniugate prevede la coniugazione della molecola di base con polietilenglicol. Sostanza questa già conosciuta in passato ed utilizzata per coniugare altre molecole farmacologicamente attive e che ha dato ottimi risultati per aumentare la persistenza in circolo.
Dopo questa premessa ricordiamo che spesso ci siamo soffermati sulla discrepanza tra gli ingenti sequestri di materiale dopante effettuati dalle forze dell’ordine e le relativamente esigue positività rilevate dal Laboratorio Antidoping. Ciò potrebbe dare origine ad errate considerazioni sull’efficienza dei Laboratori antidoping amplificate dal tentativo di discredito derivante dagli attacchi portati dai vari avvocati e periti difensori degli atleti “pizzicati” positivi.
Stante ciò, cerchiamo di capire come stanno realmente le cose con un approccio “neutrale” e per lo più scientifico.
Come già detto in passato le “basse” positività rilevate dipendono da fattori “noti” che nulla hanno a che fare con l’attività de Laboratorio quali le modalità di esecuzione dei controlli (alcune sostanze vengono ricercate solo “post gara”) e l’impossibilità tecnica di rilevazione di alcuni analiti.
Altri due importanti fattori, meno conosciuti,, contribuiscono a ridurre “le positività” infatti gli atleti “positivi” ma in possesso dell’esenzione terapeutica vengono considerati negativi e i limiti quali/quantitativi imposti per decretare la positività che sono più che garantisti per gli atleti.
Soprassedendo sul problema dell’esenzione (argomento di non semplice e breve trattazione) vorremmo soffermarci sui limiti imposti dalla WADA e sul loro significato.
Il limite del rapporto Testosterone/epitestosterone alcuni anni fa 6 oggi è 4 : ovviamente tutti “i valori” da 4 a 6 rilevati prima dell’entrata in vigore del nuovo limite sono stati considerati negativi: lo erano realmente? Ovviamente no…ma allora quella era la legge.
Interessante è il limite previsto per decretare la positività al nandrolone che è pari a 2 ng/mL. Basti pensare che la media è prossima allo zero e la moda è circa 0.4 ng/mL; il valore di 2 è praticamente uguale alla moda + 4 deviazioni standard il che equivale ad un intervallo di confidenza pari al 99.9%. Cio’ significa che un atleta con un valore pari a 1.99 ng/mL ha una probabilità di essere positivo pari al 99.9% (statisticamente equivalente alla certezza) eppure viene considerato negativo.
Ma non basta, un ipotetico valore al di sopra della soglia (2 ng/mL) viene “corretto” sia sottraendo l’incertezza del metodo (ovviamente detraendola moltiplicata per un fattore 2) sia per la densità qualora superi i 1020 gr/L. Quindi essere dichiarati positivi significa avere un valore circa uguale o superiore ai 2.5 ng/ mL, tralasciamo ogni commento non servirebbe a nulla.
Francamente, tra l’altro, non si capisce scientificamente perché se la densità supera 1020 il valore deve essere corretto (e quindi diminuito) ma se è inferiore viene lasciato inalterato ( una eventuale correzione comporterebbe un incremento del valore).
Come si può dedurre da quanto sopra “il sistema” garantisce totalmente l’atleta a tal punto che soggetti scientificamente positivi vengono classificati come negativi.
Ci si dovrebbe aspettare quindi che in caso di positività l’atleta ed il suo staff accettino serenamente “il verdetto”, quantomeno dal punti di vista Laboratoristico ma purtroppo non è cosi.
Ed in questo contesto che vorremmo far chiarezza, viste le numerose positività riscontrate negli ultimi tempi, e soffermarci sull’attendibilità della metodica utilizzata per la determinazione dell’eritropoietina ed in particolare del CERA.
E’ sconcertante il fatto che per non ammettere la colpa si si inventino le scuse più assurde, addirittura si invoca la “puntura” di una medusa con una tossina in grado di modificare l’epo umana rendendola perfettamente identica a quella commerciale (ottenuta con tecnica DNA ricombinante); giustamente è opportuno richiedere la controanalisi infatti è possibile in casi limite con una buona dose di fortuna ritrovarsi “negativi”.
Abbiamo ritenuto opportuno nel proseguo di questo lavoro di fornire ai lettori gli strumenti scientifici esemplificati (vista la complessità della materia) per potersi fare un’idea autonoma e valutare quindi “in proprio” ed obbiettivamente la situazione.
E’ bene innanzitutto esplicitare che “tutte” le nostre considerazioni, deduzioni ed osservazioni fanno capo a quanto riportato nel Documento Tecnico WADA del 2009 : Ajotte, Pascual, Gmeiner,Reichel,Lasne,Saugy, September 21, 2009 – WADA Technical Document – TD 2009 EPO – Harmonization of the method for the identification of recombinant erythropoietins (i.e epoetins) and analougues (e.g. darbepoetin and methoxypoliethylene glicol - epoetin β ). Un diverso modo di procedere non farebbe altro che accrescere confusione e dubbi su una tecnica già tanto contestata e discussa. (Indirizzo WEB).
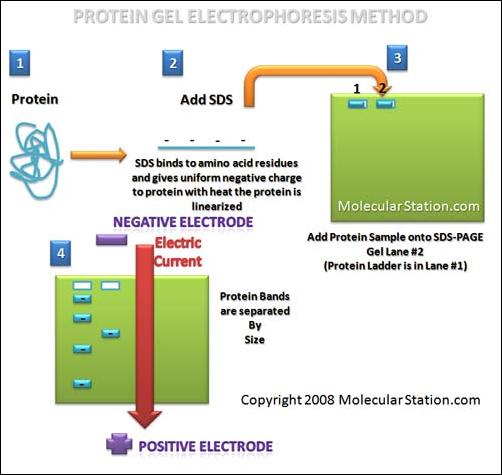
L’attuale tecnica di rilevazione usata si basa sull’immunoelettrofocusing (immunoelettroforesi a gradiente di pH) in associazine alla SDS – PAGE (Sodiododecilsolfato – poliacrilamide gelelettroforesi). L’dentificazione della sostanza si basa sul posizionamento delle isoforme nell’elettroferogramma e sul rapporto tra le loro intensità, l’SDS-PAGE, tecnica di sostegno, serve a caratterizzare la proteina individuata in base al suo peso moecolare.
Uno degli elementi di discussione e contestazione è la falsa positività, termine a volte usato in modo improprio. La comprensione della disquisizione sulle false positività necessita di alcune informazioni scientifiche che in modo esemplificato riportiamo di seguito.
In genere ci si aspetta che un test discriminante ( es. Marcatore tumorale) due categorie (es. sani – malati) sia in grado di dare risposte assolute ma ciò si verifica solamente se siamo in presenza di due distribuzioni del tipo :
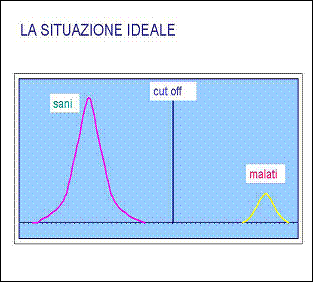
Nella realtà la situazione di cui sopra non si verifica in quanto gli estremi delle due curve si sovrappongono in modo più o meno marcato per cui il valore del cut-off definito identificherà come positivi alcuni soggetti sani (falsi positivi) e negativi (falsi negativi) alcuni soggetti malati.
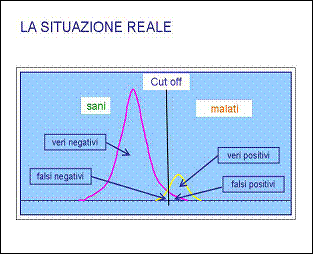
Ovviamente la scelta del valore del cut-off è estremamente delicata in quanto se scegliamo un valore basso (a sinistra) potremmo avremmo sicuramente tutti veri negativi ma rischieremmo di perdere i veri negativi. Viceversa se scegliamo un cut-off elevato (verso destra) elimineremmo i falsi negativi ma sicuramente perderemmo dei veri positivi. Ovviamente le esigenze pratiche detteranno la scelta del cut-off a seconda che si preferisca la sensibilità o la specifità del test.
Questi due parametri si definiscono statisticamente in base ad una tabella di contingenza 2x2 così rappresentata:
|
|
SANI
|
MALATI |
|
|
Val. < cut-off |
Veri negativi VN |
Veri positivi VP |
Test negativi (VN + VP) |
|
Val > cut-off |
Falsi positivi FP |
Falsi negativi FN |
Test Positivi (FP + FN) |
|
|
Soggetti Sani (VN + FP) |
Soggetti malati (VP + FN) |
Totale soggetti (VN + VP + FP + FN) |
Ove VN = Veri negativi, VP = Veri positivi, FP = Falsi positivi, FN = Falsi negativi.
In termini pratici la sensibilità è rappresentata da:
SENSIBILITA’ (ovvero positività nei malati) = VP/(VP+FN)
e la specifità da:
SPECIFICITA’ = VN/(VN + FP).
Ovviamente, sebbene nella realtà difficilmente si verifica, la sensibilità massima si ha quando FN = 0 (il metodo non dà origine ad alcun falso negativo e la specificità massima quando FP = 0 ( il metodo non dà origine ad alcun falso positivo).
Da quanto sopra si deduce che la scelta del criterio di discriminazione deve prendere in considerazione sia i falsi negativi che i falsi positivi è è quindi a mio avviso scientificamente non corretto se si ragioni soltanto in termini di falsi positivi.
Per quel che riguarda le Curve ROC il processo è simile a differenza che il tutto viene rappresentato graficamente.
Di seguito, a titolo esemplificativo, vengono riportati i dati ottenuti da Saugy et all. relativi alla metodica iniziale :
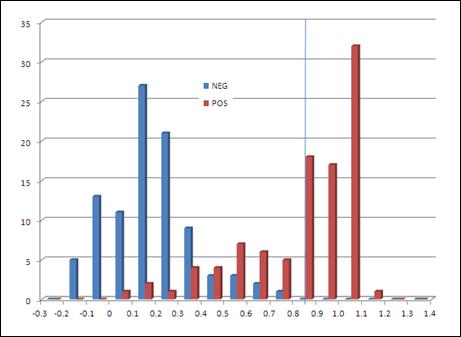
Figura 3A:Distribuzione dello score individuale ottenuto dopo cross – validazione . La linea verticale rappresenta il cut-off (0.84) scelto dal Laboratorio. line represents the cut-off (0.84 )
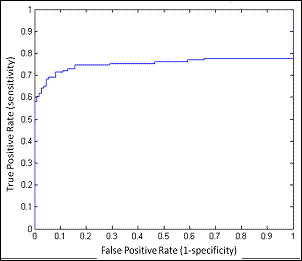
Figure3B:curva ROC rappresentante la relazione tra veri positivi (sensibilità) verso i falsi positivi(1-specificità) in accordo con il limite di cut-off stabiilito .
Ma il concetto di cui sopra è realmente applicabile alla evidenziazione di doping da EPO?.
In senso strettamente statistico non credo ci siano i presupposti in quanto l’insorgenza di una positività deriva da una serie di cofattori gran parte dovuti al caso, nel caso specifico invece, non deriva dal caso ma esclusivamente da una causa nota ovvero l’assunzione (volontaria o involontaria) di una sostanza esogena. L’approccio più corretto potrebbe essere quello di tipo Bayesiano che evito di trattare in quanto abbastanza complesso e difficilmente percettibile dai non addetti.
Per completare le informazioni necessarie esplicitiamo la procedura “SDS-PAGE” quale tecnica “ancillare” all’immunoelettrofocusing.
L’EPO, estratta per immunoaffinità, viene sottoposta a gel elettroforesi dopo trattamento con dodecilsolfato. L’SDS ha la caratteristica di denaturare le proteine e di caricarle negativamente. Le proteine assumono una struttura lineare e la carca netta negativa sarà proporzionale alla loro lunghezza, quindi, al peso molecolare. Alla fine della corsa elettroforetica la posizione nel gel sarà tanto più distante dal punto di deposito quanto minore è il peso molecolare. Utilizzando proteine a peso molecolare noto, in base alla posizione assunta, si potrà risalire con ottima approssimazione al peso della proteina oggetto di studio.
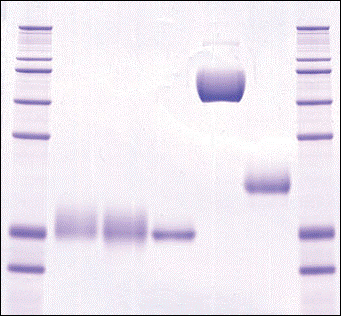
Riportiamo di seguito alcuni tracciati
significati dell’applicazione di questa tecnica a vari tipi di EPO.![]()
![]()
+ 
![]()
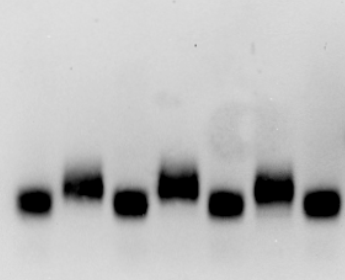
1 2 3 4 5 6 7 kDa
Nelle posizioni 1 e 7 vengono riportate 2 miscele di proteine di riferimento a pesi molecolari noti. Nelle altre posizioni vari tipi di EPO: 2 Erypo, 3 NeoRecormon, 4 Dynepo, 5 MIRCERA, 6 NESP (Appare evidente la netta differenza tra MIRCERA e le altre EPO dovuta al suo maggior peso molecolare)
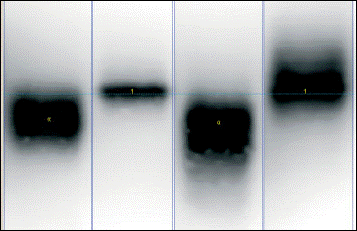
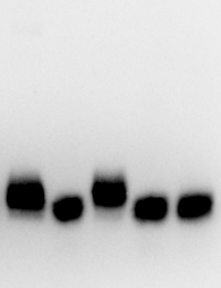
+ 1 2 3 4
Nella figura sopra sono riportati i tracciati relativi a: 1 Standard di uhEPO, 2 Dynepo, 3 Repotin, 4 NeoRecormon. La Dynepo si differenza nettamente dalle altre per la sua caratteristica “banda stretta”. (Figure tratte da Reichel et all : SDS-PAGE of recombinant amd endogenous erythropoietins: benefits and limitatiions of the method for application in doping control. Drug test,Analysis 2009,1,43-50
LE CRITICHE![]()
Passiamo ora ad elencare ed analizzare le
critiche scientifiche che negli anni hanno accompagnato questo metodo anche,
ovviamente, alla luce delle attuali esperienze.
|
Lunghezza della procedura di preparazione del campione Bassa capacità di carico Difficoltà di standardizzazione inter del laboratorio a causa di gel ed anfoliti non riproducibili Legame aspecifico dell’anticorpo secondario Problemi di sensibilità Costi elevati |
Parte di questi problemi quali i costi e la bassa sensibilità restano attuali ma molto è stato fatto per la soluzione degli altri. Infatti, la procedura di double-blotting elimina le interferenze da parte delle proteine urinarie con l’anticorpo secondario e l’estrazione dell’EPO dal campione per immunoaffinità, oltre che a ridurre i tempi di estrazione abbatte quasi totalmente le proteine urinarie non oggetto di determinazione.
Infatti Lasne et all, ultimamente hanno descritto un sistema di estrazione basato sulla cromatografia per immunoaffinità utilizzando un nuovo anticorpo monoclonale specifico, clone 9C21D11, che rafforza in modo indiscutibile la specificità del metodo. Altresì. l’uso di questa procedura consente di poter determinare l’EPO anche su campioni di sangue, ove l’effetto matrice proteica rappresenterebbe un problema insormontabile, aumentando la sensibilità del metodo in quanto l’EPO plasmatica è nettamente più elevata di quella urinaria.
Molto si è discusso e si continua a discutere sui “falsi positivi”, termine a volte usato in modo improprio, mentre passa quasi inosservato il problema dei “falsi negativi” che forse rappresenta il vero limite di questa tecnica analitica.
La principale causa di “falsa positività” viene attribuita alla provata aspecificità dell’anticorpo AE7A5.
Kan et all. hanno identificato cross-reazioni dell’anticorpo con proteine urinarie (in particolare quelle da “proteinuria da sforzo”) che hanno punti isoelettrici (3-5) e massa simile all’EPO quali la glicoproteina di Tamm-Horsfall, l’α1 – antichimotripsina, l’inibitore della α2 – tiol-proteinasi, l’ α2 –HS- glicoproteina.
Altresì l’anticorpo reagisce inoltre con un largo numero di proteine batteriche come la tioredoxinreduttasi da Escherichia coli, con proteine extra e intracellulari del tessuto uroteliale ed anche con un certo numero di proteine del Saccaromiceto cervisiae, non di rado presenti nelle urine umane.
Ci preme rilevare comunque che Reichel C. (Jounal mass spectrometry,2008 – vol.43 pp 916-23) riscontra si il legame aspecifico tra l’anticorpo (clone AE7A5) con una Zinco α2 – glicoproteina, ma determina che tale legame si manifesta per elevate concentrazioni di questa ed al di fuori del range di pH operativo nell’IEF.
Ma la presenza di queste proteine nel campione da analizzare difficilmente porterebbe ad un referto di “positività” in base alle disposizioni riportare nel già citato TD2009EPO.
Infatti,soprassedendo da banali attività da espletare prima e dopo il prelievo che potrebbero eliminare/evidenziare la presenza di batteri/miceti o “proteinuria da sforzo”, è praticamente impossibile che la cross-reazione di queste proteine con l’anticorpo possa alterare il profilo IEF della huEPO così selettivamente da renderlo uguale a quello della rhuEPO.
Infatti i criteri del TD2009EPO per la dichiarazione di positività (relativamente alle “other EPO”, per le altre il discorso è ancora più semplice) non soltanto prevedono che l’intensità delle bande nell’area “basica” debba superare l’85% del totale (aspetto quantitativo), ma anche che siano presenti almeno tre bande caratteristiche e che le due bande più intense debbano essere consecutive.
Altresì, nei casi in cui il profilo IEF non sia un profilo tipico sono previsti dei test addizionali (Additional Evidence) quali la SDS-PAGE, l’elettroforesi bidimensionale o equivalenti metodi di separazione delle proteine a complemento delle informazioni ottenute con l’IEF.
Ulteriore tecnica che merita attenzione riteniamo sia l’immunoblotting prima e dopo trattamento con N-glicosidasi : rimuovendo le catene glicidiche N-legate la massa apparente delle isoforme dell’EPO passa da 32-39 kDa a 18, mentre con lo stesso trattamento nelle proteine indotte da sforzo, non si verifica un shift così elevato.
I tracciati di seguito riportati esplicitano quanto detto sopra.
| cathode | band id. | band id. |
band id. |
|||||
|
basic area
endogenous
acidic area anode
|
6 5 4 3 2 1
|
 rEPO (BRP std) |
|
uEPO (NIBSC std) |
a
|
 NESP (Aranesp TM) |
CERA (Mircera TM) |
|
|
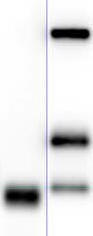
Image of the identification windows of lanes obtained by the chemiluminescence acquisition system corresponding to the analysis of rEPO, CERA, NESP and uEPO. |
||||||||
| rEPO (BRP std) |
Erypo | Norecormon | Hemax | Alfaepoetina |
| cathode 97 kDa
55 kDa
31 kDa
|
   |
CERA (mircera TM)
NESP
epoetin delta |
| anode | uEpo (NIBSC std) |
|
|
Image of the SDS-PAGE
analysis of endogenous urinary EPO (uEPO), |
FALSI NEGATIVI![]()
Pertanto, come precedentemente accennato, il punto debole di questa tecnica
è la sensibilità ovvero il gran numero di “falsi negativi”.
Le cause della “falsa negatività” vanno individuate sia nelle tecniche di mascheramento messe in atto da atleti truffaldini (aggiunta di proteasi che distruggono l’EPO), l’elevata attività proteasica nell’urina dopo elevata concentrazione, l’instabilità della molecola, la bassa concentrazione dell’EPO nelle urine e la bassa emivita dell’EPO endogena.
Tanto ciò premesso si continua con le osservazioni che dovrebbero essere più comprensibili alla luce di quanto sopra esposto ricordando che non è mai stato dimostrata scientificamente l’esistenza di una molecola con caratteristiche tali da dare una falsa positività applicando la metodica e i criteri attualmente in uso.
Scendendo nei particolari discutiamo su quanto riportato in un lavoro recente (Inaccuracies of laboratory methodologies in antidoping testing, Clinica Chimica Acta 2010).
Gli autori citano testualmente “..Nonostante il notevole numero di atleti sleali trovati positivi, la validità di questo metodo è discutibile: c’è un numero significativo di casi falsi positivi a causa della cosiddetta urina da sforzo. La proteinuria aumenta sistematicamente dopo sforzo ed è responsabile di risultati falsamente positivi”.
Vengono riportati come riferimenti bibliografici i seguenti lavoti:
Franke WW et al., Pitfalls, errors and risks of false-positive results in urinary EPO drug tests, Clin Chim Acta 2006;373:189-90;
Beullens M et al., False-positive detection of rhu-EPO in urine following strenuous physical exercise, Blood 2006; 107:4711-3.
Orbene, trattandosi di lavori del 2006 e utilizzando i criteri di positività allora codificati, sarebbe interessante conoscere se, applicando le nuove direttive WADA (TD2009EPO), gli autori siano ancora dello stesso avviso.
Tra l’altro il lavoro di Buellens e Delange è stato aspramente contestato da altri autori. In una “lettera all’editore” (Blood 1 september 2006, Vol 108, N. 5) Catlin, Green, Sekera e Scott riportano: “Siamo in disaccordo con Beullens sull’uso del termine falso positivo in quanto il composto in oggetto non è rhu-EPO. Per cui se il composto può essere identificato come non-EPO, non può essere la causa di una falsa positività”.
Continuano:
“I criteri utilizzati dai Laboratori WADA sono ben conosciuti e prontamente disponibili. Beullens et al. non precisano i criteri utilizzati per dichiarare la falsa positività. Utilizzando i criteri della WADA, il falso positivo il cui elettroferogramma é riportato in Fig. 1A è chiaramente negativo.”
E concludono con osservazioni sull’atleta oggetto di osservazione:
“Infine, l’atleta ha una patologia renale sconcertante caratterizzata da un difetto di concentrazione e da un eccessivo numero di cilindri (jalini) che apparentemente non interferiscono con le capacità atletiche. Dovrebbe essere sottoposto ad una completa valutazione nefrologica”.
In sostanza, il messaggio che traspare è che per trovare un’interferenza (non un falso positivo) da proteinuria da sforzo si è dovuto ricorrere ad un soggetto con patologia renale associata.
Francamente, visto l’ottimo lavoro pubblicato, pensiamo che gli autori abbiano dimenticato di riportare queste valide considerazioni presenti in letteratura.
Altra considerazione nello stesso lavoro, che induce particolari riflessioni, viene riportata di seguito:
“L’alta imprecisione del metodo è stata altresì dimostrata dalla spedizione di campioni prelevati da soggetti trattati con rhu-EPO. Otto individui sono stati studiati per 7 settimane. Inizialmente sono stati trattati con rhu-EPO per 4 settimane (2 settimane di “potenziamento” seguite da 2 settimane di mantenimento), poi seguito da un periodo di post-trattamento di 3 settimane. I campioni di urina ottenuti durante tutto lo studio sono stati inviati a due laboratori accreditati. Il primo laboratorio classifica come “positivi” tutti i campioni raccolti durante il periodo di “potenziamento”, mentre l’altro laboratorio non ne classifica nessuno come “positivo”. Nel periodo di “mantenimento” il primo laboratorio individua sei casi positivi e due sospetti su 16 campioni e l’altro laboratorio solo cinque casi sospetti. Nel periodo post-trattamento il primo laboratorio riporta due casi positivi e tre sospetti, mentre nessun caso positivo viene rilevato dall’altro laboratorio.
Così si può concludere che le attuali performance del test IEF per l’EPO sono un po’ deludenti, i maggiori ostacoli si identificano nel “bias” analitico dovuto alla complessa preparazione del campione, nella sensibilità sub ottimale e nella mancanza di standardizzazione”.
Considerazioni che si riferiscono al lavoro di Lundby et al “Testing for recombinant human erythropoietin in urine: problems associated with current anti-doping testing”, J Appl Physiol 105: 417-419, 2008.
Al di là dei limiti scientifici (lo stesso Lundby afferma che più laboratori avrebbero dovuto partecipare all’esperimento), ovviamente condividendo le affermazioni degli autori sull’imprecisione del metodo, non possiamo fare a meno di sottolineare che, nel caso specifico, tale imprecisione è dovuta esclusivamente all’abnorme presenza di “falsi negativi”, fattore a nostro avviso molto importante nel contesto di questo articolo.
Comunque ritengo che le considerazioni sulla metodologia analitica per la rilevazione dell’EPO dovrebbero essere effettuate facendo riferimento al TD2009EPO; riferimenti su metodi anacronistici potrebbero dare origine ad errate conclusioni.
Una strenua e interessante difesa tecnica portò all’assoluzione dell’atleta Rutger Beké; Interessanti sono le argomentazioni e quindi argomento altrettanto interessante per controdeduzioni.
“# 1: siamo in
grado di provare che il campione di urina di Rutger è stato contaminato da
batteri. Il pH urinario è aumentato in modo significativo da 5 a 5,8-6,3
durante le 15 ore tra il prelievo del campione e l'inizio del test A (detta
fase pre-analitica); il risultato di questa contaminazione ha dato origine a
molteplici reazioni chimiche nelle urine. Il risultato finale di tutte
queste reazioni è che quasi tutta l’EPO endogena è stata distrutta da enzimi
proteolitici prima che il test A fosse iniziato. Questo è visibile guardando
il tracciato IEF (isoelettrofocusing), che è il risultato finale del test di
ricerca dell’EPO nelle urine. E' noto dalla ricerca del professor Delanghe
(si veda la # 2) che costantemente Rutger ha un livello serico di EPO
endogena che è circa 4 volte superiore
al normale. Così egli dovrebbe anche avere circa 4 volte la quantità media
di EPO endogena nelle sue urine. Ciò significherebbe che le bande di EPO
nell’IEF dovrebbero avere un colore molto più intenso rispetto a quello
degli altri triatleti testati. Tuttavia, la IEF mostra che le bande di
Rutger sono le meno intense di tutti gli altri triatleti testati a Knokke.
Ciò conferma che la maggior parte della sua EPO dovrebbe essere stata
distrutta durante la fase pre-analitica! Sei esperti nel campo della
biochimica e chimica clinica indipendenti sono giunti alla stessa importante
conclusione che gli errori pre-analitici ,in questo caso, erano evidenti".
Analisi corretta ma fondata su ipotesi. Innanzitutto non riusciamo a
capire per quale motivo l’attività proteasica si debba manifestare soltanto
a carico dell’EPO endogena, per similitudine molecolare anche l’EPO esogena
dovrebbe subire la stessa sorte ed essendo presente in quantità nettamente
inferiore le bande sarebbero dovute addirittura scomparire. Azzardiamo
quindi un’altra ipotesi: l’assunzione di EPO esogena non potrebbe aver
portato alla riduzione dell’intensità delle bande esogene per effetto
“rebound”? Nel caso specifico il valore dei reticolociti avrebbe potuto
aiutare ma non è disponibile.
# 2: Rutger
Beke ha particolari caratteristiche genetiche che influenzano molti dei suoi
parametri ematici: la sua concentrazione endogena di EPO è superiore di un
fattore 4 a quella di un individuo normale. Ha inoltre costantemente
aumentato il livello di sFtr (recettore solubile della transferrina), una
proteina che conferma una maggiore attività del midollo osseo. Il carattere
genetico di queste caratteristiche è confermato dai profili di sangue di suo
fratello e suo padre. Tutti questi fattori sono stati determinati sotto la
supervisione del professor Delanghe.
# 3: E' abbastanza strano che, nonostante il fatto che la maggior parte
dell’EPO nelle urine di Rutger sia stata distrutta, però siano ancora
visibili le bande tipiche di EPO esogena nell’IEF di Rutger. Come si può
spiegare?
Ciò è dovuto al fatto che è geneticamente incline a Rutger nell'esercizio
fisico la perdita urinaria di proteine. A seguito di un intenso esercizio
fisico (come un Triathlon Olimpico) l’urina di Rutger contiene una quantità
enorme di molte proteine (questo è stato determinato in modo molto
dettagliato dal Prof. Delanghe). Scientificamente il fenomeno è noto come
proteinuria "indotta dall'esercizio (misto-tubolare tipo glomerulare)". Una
delle proteine che sono presenti in quantità inusuale nelle urine di Rutger
è la alfa 1-antichimotripsina (alfa1-ACT). Recentemente è stato dimostrato
in un laboratorio australiano (ricerca in parte effettuata nell'ambito di
una borsa di studio WADA!) che questa alfa1-ACT è omologa alla EPO esogena
(e reagisce nello stesso modo dell’EPO esogena nel test per l’EPO urinaria).
Come risultato l’alfa1-ACT produce lo stesso tipo di bande dell’EPO
ricombinante nell’IE . Per questo motivo nell’IEF delle urine di Rutger, si
trovano queste bande esogene tipo EPO. Quindi, per dirla semplicemente: noi
crediamo di vedere EPO esogena nelle urine, ma in realtà è solo alfa1-ACT!
|
Interessanti osservazioni e corrette, soltanto non sufficienti per giustificare le negatività dell’atleta ai precedenti test antidoping. La tesi che soltanto in quella circostanza sia comparsa la “proteinuria indotta da esercizio” sembra difficilmente sostenibile. Per quanto riguarda la reazione aspecifica dell’ alfa1-ACT (Alfa 1-antichimotripsina), nel contesto attuale se pur dimostrato che possa legarsi all’anticorpo AE7A5 ben difficilmente le bande di legame aspecifico si collocherebbero nella stessa posizione e con la stessa intensità di quelle relative alla rhu-EPO. Infatti, come detto in precedenza, Reichel C., in un lavoro su Journal of Mass Spectrometry (2008, vol 43, N. 7) ha evidenziato un legame aspecifico tra l’anticorpo AE7A5 e una zinco-alfa-2-glicoproteina ma questo si forma a pH diversi da quelli a cui viene condotta l’IEF e soltanto se la concentrazione della glicoproteina è assai elevata. |
# 4: WADA è a
conoscenza dei potenziali problemi di cui ai punti 1 e 3. Fino a qualche
settimana fa avevano una relazione sul loro sito web: "Rapporto di
valutazione del test dell’EPO in urina”, scritto da Dott. G. Peltre e Prof
Dr Thormann per il Consiglio della WADA. La relazione cita i problemi con i
campioni di urina che vengono contaminati nella fase pre-analitica (punto 1)
e problemi di proteine che potrebbero dare macchie o bande nella zona per
EPO esogena nell’IEF (point 3). Uno dei risultati di questa relazione è che
WADA ha dato borse di ricerca a vari laboratori di tutto il mondo per
esaminare i problemi di cui alla presente relazione e di trovare potenziali
miglioramenti del test. Come accennato in precedenza un laboratorio
australiano ha provato che la presenza di alcune proteine (una di esse la
alfa1-ACT) comporta la presenza di bande simili a quelle dell’EPO esogena
nell’IEF. Il laboratorio ha anche proposto un metodo migliore che sarà in
grado di distinguere tra EPO esogena e queste altre proteine.
|
Discorso sostanzialmente corretto alla luce delle modalità di esecuzione del test a quella data (2005), è logico che le nostre deduzioni siano tratte alla luce delle ultime raccomandazioni emanate. |
# 5: Non abbiamo intenzione di dimostrare che l'attuale test per l’EPO nelle urine non funziona! Probabilmente funziona bene per molti. Quello che diciamo è che per gli atleti affetti da una particolare patologia, come Rutger Beke, bisogna prestare scrupolosa attenzione durante la fase pre-analitica e durante l'interpretazione della prova, in modo che un falso positivo possa essere evitato. Prima di tutto è indispensabile evitare la contaminazione delle urine (seguita da reazioni chimiche) nella fase pre-analitica. Anche questo è spiegato in dettaglio nel documento del Dott. Peltre e del Prof. Dr. Thormann di cui sopra. Il campionamento delle urine prima della gara sarebbe già in grado di eliminare la grande maggioranza dei problemi. In secondo luogo si dovrebbe integrare e migliorare la fase analitica (nei laboratori antidoping) per scoprire la differenza tra EPO esogena e proteine omologhe che danno le stesse bande nell’IEF.
|
La proposta del campionamento prima della gara è condivisibile ma difficilmente praticabile: visto che non tutti gli atleti possono essere sottoposti a controllo anti-doping, con quale criterio valido si selezionerebbero i candidati? |
# 6: Molti si chiederanno il
perché Rutger, che ha tutte queste particolarità, non sia stato mai trovato
positivo nei precedenti controlli.
Riteniamo
che la spiegazione sia la seguente: come abbiamo spiegato al # 1, le urine
di Rutger che sono risultate positive sono state contaminate da batteri e si
è trovata una piccola quantità di EPO endogena all'inizio della prova sui
campioni A e B. Se l'urina di Rutger non
fosse stata contaminata, avrebbe dovuto contenere una quantità di EPO
endogena circa 4 volte di più che una persona normale. Nella foto IEF, ciò
avrebbe comportato bande molto più intensamente colorate, quasi
completamente sul lato sinistro delle bande causate da alfa1-ACT (ed
erroneamente interpretate come bande esogene di EPO). Quando si applica
l'ultima regola WADA di dichiarare la presenza di EPO esogena, o di
applicazione della norma precedente (80% nella zona a destra), in entrambi i
casi Rutger darebbe un risultato negativo! Inoltre, le particolari
condizioni al Zwintriathlon (temperatura ambiente, la deidratazione,
l'intensità della gara che inducono una massiccia proteinuria) e la cattiva
conservazione del campione possono indurre la distruzione della fragile
struttura dell’EPO ed aumentare fortemente il rischio di errori
pre-analitici.
| Premesso che il test è comunque selettivo per l’EPO, è possibile che altre proteine possano provocare interferenze che sono pur sempre evidenziabili. Ovviamente in base alle conoscenze attuali. Per esempio, nel caso di cui sopra sarebbe stato sufficiente addizionare ad aliquote del campione di urina (inquinata da proteasi) vari tipi di EPO ricombinante e farle migrare insieme al campione integro ed allo standard. Con un simile procedimento la presenza di proteasi sarebbe sicuramente dimostrata in quanto le bande relative ai campioni “addizionati” sarebbero sicuramente diverse come intensità e posizione rispetto agli standard. |
IL RUOLO DEI PERITI![]()
Nelle fasi
dibattimentali dei processi per doping, l’attività dei periti (CTU e di
parte) gioca un ruolo determinante per l’esito finale di giudizio. La
preparazione dei Magistrati sugli aspetti procedurali ovviamente è fuori
discussione ma, date le carenze sul piano prettamente scientifico, la
decisione finale è inevitabilmente influenzata dalla bontà e dalla
credibilità delle relazioni scientifiche.
In genere, nelle mie perizie ho sempre cercato di “volgarizzare” le argomentazioni scientifiche in moda da poter fornire al Magistrato un minimo di elementi di base che potessero consentirgli un margine di valutazione autonomo nel giudizio finale. Quanto segue non deve essere interpretato come una vera e propria controperizia ma soltanto come un’esercitazione accademica che pur sempre ritengo abbia una sua valenza didattica.
Dietro richiesta del mio amico Eugenio Capodacqua di effettuare delle osservazioni a quanto parzialmente riportato su stralci di una periza riguardante un caso importante, ho accettato di formulare personali considerazioni ed osservazioni.
La perizia contesta sia in termini procedurali che esecutivi il referto di positività ad EPO “MIRCERA” di un atleta di rango.
“Assenza di validazione della tecnica e del metodo applicati. A quanto é noto, non é ancora disponibile una validazione ufficiale della tecnica e del metodo applicato dal Laboratorio “AFLD” nell'analisi del Campione B. La validazione di un metodo analitico conferma attraverso l'esame e l'apporto di evidenza oggettiva che i requisiti particolari per l'utilizzazione prevista siano soddisfatti. Il laboratorio che utilizza un metodo deve possedere la documentazione che dimostri l'appropriata validazione del metodo stesso ed è responsabilità dell'utilizzatore assicurare che la validazione documentata sia completa. I parametri che caratterizzano un metodo analitico sono: ▪ campo di misura; ▪ specificità-selettivita analitica; ▪ limite di rivelabilità e di quantificazione; ▪ range dinamico e lineare; ▪ accuratezza intesa come esattezza più precisione (quest'ultima a sua volta distinta in ripetibilità, precisione intermedia e riproducibilità); ▪ incertezza di misurazione; ▪robustezza.
| Allo stato attuale sembra che la validazione della tecnica e del metodo utilizzato siano fuori discussione anche alla luce del fatto che il metodo utilizzato è praticamente lo stesso utilizzato per le altre rhEPO : si utilizzano gli stessi reagenti nell’esecuzione del double blotting, quel che varia è l’introduzione di criteri interpretativi per la presenza di Mircera in quanto molecola di recente introduzione. Non si tratta di “nuovo metodo” ma soltanto di una “estensione” di un metodo preesistente già ampliamente validato, come recentemente confermato dal Tas, il tribunale arbitrale dello sport |
“Le analisi sono state eseguite mediante IEF-immunoblotting chemiluminescenza, metodo qualitativo che permette di separare proteine sulla base del loro Punto Isoelettrico. Sulla scorta di tale caratteristica, non é possibile stimare una relazione lineare tra la risposta di chemiluminescenza e la quantità di MIRCERA, tantomeno di dirimere risultati falsi positivi.”
|
Dubito che data la particolarità di questo esame, a mio avviso assimilabile più alla diagnostica per immagini (variabile dicotomica anziché continua) che a un metodo di prova classico, l’applicazione pedissequa delle norme 17025 potrebbe inficiare “la robustezza” del test. L’impossibilità di stima della linearità tra la risposta chemiluminescente e la quantità di MIRCERA non sembra un problema determinante. Lo sarebbe qualora si trattase di una variabile monotona in cui l’esito diagnostico è strettamente legato al superamento del limite espresso da una funzione lineare del tipo y=ax + c o un limite stabilito da algoritmi linearizzanti. Nella fattispecie trattasi di stabilire se c’è o non c’è EPO in relazione alla presenza di bande caratteristiche e del rispetto dei loro rapporti quantitativi relativi. |
“Trattandosi di un metodo multianalita, sussiste l'imprescindibilità della dimostrazione della specificità per singolo analita. Con tale metodo sono possibili risultati falsi positivi per interferenze con campioni reali positivi per altre sostanze di natura proteica o mediante aggiunta di possibili interferenti (analoghi, omologhi)”.
|
L’affermazione di cui sopra non mi è chiara. Non capisco a cosa serva la dimostrazione della specificità per singolo analita quando la positività deve essere decretata dalla presenza di tutte le bande relative alla molecola ricercata, e in più le stesse debbono anche rispettare la posizione prevista nell’elettroferogramma (uguale a quella del materiale di riferimento) nonché i rapporti quantitativi tra di loro. Certamente problemi di carry-over possono sempre verificarsi, come aggiunta di omologhi ma implicherebbero gravi responsabilità da parte del Laboratorio che non prendo nemmeno in considerazione. Tra l’altro non basterebbe la presenza di una sola molecola per decretare un falso positivo ma la presenza di almeno tre-quattro molecole diverse tra di loro; inoltre la loro presenza dovrebbe essere in rapporto stechiometrico equivalente a quello delle isoforme della rhu-EPO. Non solo, la struttura stereochimica e le interazioni elettrostatiche dovrebbero essere tali da far coincidere i loro punti isoelettrici con quelle oggetto di esame. In termini probabilistici potremmo ipotizzare eufemisticamente: poco probabile. |
“Altresì si riporta che la mancanza di validazione del metodo ha alcune sue profonde conseguenze anche, naturalmente, in termini di affidabilità dello stesso, provate da fatti oggettivi quali il problema dei falsi positivi.”
|
Pur ammettendo per ipotesi la mancanza di validazione del metodo, non si comprende la relazione che possa sussistere tra questa mancanza e il problema dei “falsi positivi”. Precedentemente abbiamo riportato la risposta di Catlin a Buellens e abbiamo ampiamente discusso il problema dei “falsi positivi” . Se poi ci riferiamo alla proteinuria da sforzo, è vero che diverse molecole possano cross-reagire con l’anticorpo AE7A5 ma i criteri stabiliti per declarare una positività sono tali da evidenziare tali anomalie. Inoltre, Lasne ha modificato il processo di purificazione e concentrazione del campione introducendo la cromatografia per immunoaffinità. L’anticorpo monoclonale anti-EPO utilizzato è del tipo 9C21D11 per cui ci troviamo in pratica di fronte ad una determinazione con doppio anticorpo by-passando anche i problemi connessi all’estrazione con setacci molecolari a 30 kD aumentando la specificità. |
“Sinopsi di sorta e osservazioni: (…) Quale é l'incertezza del metodo di identificazione? Trattandosi di metodo qualitativo (presenza/assenza) la misura dell'incertezza potrebbe essere data in curva ROC o Contingency Table o altre modalita. Tuttavia, per ottenere tale dato, un congruo numero di campioni dovrebbe essere analizzato con due metodi, uno da validare e l'altro di riferimento”.
|
Orbene, al di là del fatto che le curve ROC sono già state effettuate in precedenza (vedi figura), essendo un metodo ideato per particolari esigenze (non cliniche) e l’unico disponibile, ci si chiede quale possa essere l’altro metodo di riferimento ipotizzato con cui compararlo. In definitiva e concludendo pensiamo che il test per quanto riguarda “le positività” sia altamente affidabile, molto meno viceversa per le “false negatività” e proprio per questo è consigliabile ricorrere sempre al test di conferma : vista la bassa concentrazione di EPO e la quantità di materiale che si perde (o decade) nei vari step analitici si può sempre sperare…di farla franca. |